Simulado UFAC de Quimica | VESTIBULAR
📚 Simulado UFAC | Vestibular | cód.8055
Um bom desempenho começa com preparação. Faça o simulado UFAC agora mesmo! 📊
🎯 São milhares de simulados para concurso disponíveis para você praticar e conseguir a tão sonhada aprovação em Concurso Público.
🧪 Este Simulado UFAC foi elaborado da seguinte forma:
- 📌 Categoria: Vestibular
- 🏛️ Instituição: UFAC
- 👔 Cargo: Vestibular
- 📚 Matéria: Química
- 🧩 Assuntos do Simulado:
- 🏢 Banca Organizadora: UFAC
- ❓ Quantidade de Questões: 20
- ⏱️ Tempo do Simulado: 60 minutos
⚙️ REGRA DO SIMULADO
Este simulado é gratuito 🆓. Basta clicar no botão iniciar abaixo e preencher um breve cadastro para participar do nosso ranking.
📊 No ranking você compara sua nota com outros candidatos e acompanha sua evolução nos estudos.
🚀 Aproveite este simulado UFAC e saia na frente na sua preparação!
📖 Questões UFAC
Se ainda não estiver pronto para fazer o simulado, treine antes com nossas questões de concursos:
🎥 Vídeo Aula
Confira vídeo aulas no YouTube com foco no concurso UFAC. Estude com conteúdo gratuito e atualizado.
Assistir vídeo aula sobre UFAC
📚 Apostila
Encontre apostilas completas e materiais didáticos atualizados para o concurso UFAC.
📢 Concursos Abertos para UFAC
Veja os concursos abertos da instituição UFAC. A lista está sempre atualizada:
🍀 Boa sorte e Bons Estudos,
ConcursosAZ - Aprovando de A a Z ✅
- #120210
- Banca
- UFAC
- Matéria
- Química
- Concurso
- UFAC
- Tipo
- Múltipla escolha
- Comentários
- Seja o primeiro a comentar
(1,0) 16 -
A água oxigenada comercial, uma solução aquosa de peróxido de hidrogênio H2O2, é um poderoso oxidante que devido a essa propriedade possui diversos usos, como por exemplo: no clareamento de cabelos, como agente antisséptico, na medicina veterinária, no tratamento de acne, entre outros. Normalmente, a água oxigenada deve ser guardada em frascos escuros que não permitam a passagem de luz, pois o peróxido de hidrogênio se decompõe rapidamente na sua presença, segundo a reação:

O gráfico a seguir, apresenta o perfil da decomposição H2O2 de ao longo do tempo de um experimento realizado com água oxigenada.
Considerando a reação química e o gráfico apresentados, e ainda que o tempo inicial é igual a zero, é correto afirmar que:
- a) No decorrer de 1.200 segundos, a decomposição H2O2 de foi de 1/4 da concentração inicial.
- b) A decomposição do peróxido de hidrogênio é descrita por uma função afim.
- c) No decorrer de 1.800 segundos, o módulo da velocidade média de decomposição de H2O2 foi de, aproximadamente, 0,02 mol.L-1 .min-1 .
- d) O tempo de 1.800 segundos é referente à decomposição de um oitavo da quantidade inicial peróxido de hidrogênio.
- e) Em 600 segundos, para cada litro de solução H2O2 de decomposto, foram formados 0,40 mol de gás oxigênio.
- #120211
- Banca
- UFAC
- Matéria
- Química
- Concurso
- UFAC
- Tipo
- Múltipla escolha
- Comentários
- Seja o primeiro a comentar
(1,0) 17 -
As sulfonamidas são fármacos sintéticos muito utilizados para tratar infecções por bactérias do tipo gram-positivas e gram- negativas. Essas substâncias são derivadas da p-amino benzeno sulfonamida, cuja estrutura é:
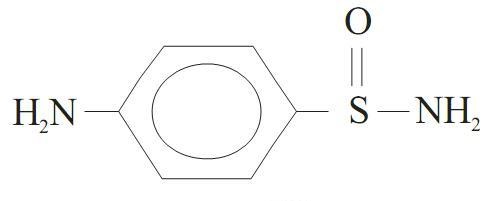
Algumas sulfonamidas podem ser potencialmente carcinogênicas e ainda podem causar efeitos colaterais, como reações alérgicas ou tóxicas em algumas pessoas.
Analisando-se os grupos funcionais presentes na p-amino benzeno sulfonamida, pode-se dizer que está presente a função:
- a) Amina.
- b) Amida.
- c) Anilina.
- d) Ácido carboxílico.
- e) Sulfato.
- #120212
- Banca
- UFAC
- Matéria
- Química
- Concurso
- UFAC
- Tipo
- Múltipla escolha
- Comentários
- Seja o primeiro a comentar
(1,0) 18 -
Um professor de química, em uma aula sobre ácidos e determinação de pH (potencial hidrogeniônico), resolveu diferenciar sua aula utilizando um rótulo de vinagre comercial, que continha a seguinte informação:
Concentração de ácido acético: 6,0% m/V.
Ao explicar que o vinagre é uma solução aquosa de ácido acético (ácido etanóico), o professor deixou o seguinte questionamento valendo um ponto na média: “Qual o pH do vinagre?”
As seguintes informações foram fornecidas pelo professor:

Assim, ganhará o ponto o aluno que responder que o pH é aproximadamente:
- a) 7,0.
- b) 1,2.
- c) 2,4.
- d) 9,6.
- e) 5,0.
- #120213
- Banca
- UFAC
- Matéria
- Química
- Concurso
- UFAC
- Tipo
- Múltipla escolha
- Comentários
- Seja o primeiro a comentar
(1,0) 19 -
Nos aparelhos portáteis modernos, usados com freqüência na atualidade, como filmadoras, computadores, máquinas fotográficas digitais e telefones celulares, as baterias de íons de lítio vêm sendo cada vez mais utilizadas, porque possuem inúmeras vantagens frente a outros modelos, dentre eles as de níquel e cádmio e níquel metal hidreto. Além de armazenarem muito mais energia, as baterias de lítio proporcionam um tempo maior de uso sem recarga, são mais leves, não são afetadas pelo efeito memória e podem ser recarregadas sem a necessidade de esperar a descarga total. Isso sem falar que ainda diminuem o risco ambiental, principalmente quando comparadas às baterias que contém cádmio, que é um metal pesado que produz graves efeitos tóxicos aos organismos vivos, mesmo em concentrações muito pequenas.
A figura a seguir, ilustra um esquema do processo eletroquímico que ocorre nas baterias de íons de lítio.
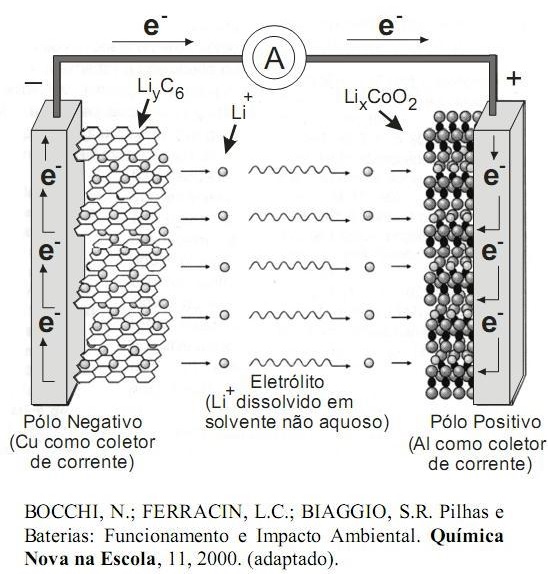
Dessa forma, na descarga da bateria, as reações químicas nos dois pólos são:
Pólo Negativo:
LiyC6 (s) → C6 (s) + y Li+ (solv.) + y e-
Pólo Positivo:
LixCoO2(s) + y li+ (solv.) + y e- → lix+yCoO2(s)
Sobre tais reações, pode-se dizer que:
- a) A substância LicCoCO2 sofre oxidação.
- b) A substância LiyC6 é agente redutor.
- c) A reação do pólo positivo é uma oxidação e, portanto, ocorre no anodo da pilha.
- d) A reação do pólo negativo é uma redução e, portanto, ocorre no catodo da pilha.
- e) A reação do pólo negativo é uma oxidação e, portanto, ocorre no catodo da pilha.
- #120214
- Banca
- UFAC
- Matéria
- Química
- Concurso
- UFAC
- Tipo
- Múltipla escolha
- Comentários
- Seja o primeiro a comentar
(1,0) 20 -
A borracha natural, produzida principalmente a partir do látex de uma árvore originária da Amazônia brasileira, Hevea brasiliensis (seringueira), é um polímero natural da molécula do isopreno, cuja estrutura pode ser representada por:

A respeito dessa molécula, é correto afirmar que:
- a) Possui quatro carbonos hibridizados da forma sp3 .
- b) Possui quatro ligações do tipo sigma.
- c) Possui fórmula molecular C5H6
- d) Não possui carbonos com hibridização do tipo sp.
- e) Não possui átomos de hidrogênio.

