Simulado UFAC de Quimica | VESTIBULAR
📚 Simulado UFAC | Vestibular | cód.8055
Um bom desempenho começa com preparação. Faça o simulado UFAC agora mesmo! 📊
🎯 São milhares de simulados para concurso disponíveis para você praticar e conseguir a tão sonhada aprovação em Concurso Público.
🧪 Este Simulado UFAC foi elaborado da seguinte forma:
- 📌 Categoria: Vestibular
- 🏛️ Instituição: UFAC
- 👔 Cargo: Vestibular
- 📚 Matéria: Química
- 🧩 Assuntos do Simulado:
- 🏢 Banca Organizadora: UFAC
- ❓ Quantidade de Questões: 20
- ⏱️ Tempo do Simulado: 60 minutos
⚙️ REGRA DO SIMULADO
Este simulado é gratuito 🆓. Basta clicar no botão iniciar abaixo e preencher um breve cadastro para participar do nosso ranking.
📊 No ranking você compara sua nota com outros candidatos e acompanha sua evolução nos estudos.
🚀 Aproveite este simulado UFAC e saia na frente na sua preparação!
📖 Questões UFAC
Se ainda não estiver pronto para fazer o simulado, treine antes com nossas questões de concursos:
🎥 Vídeo Aula
Confira vídeo aulas no YouTube com foco no concurso UFAC. Estude com conteúdo gratuito e atualizado.
Assistir vídeo aula sobre UFAC
📚 Apostila
Encontre apostilas completas e materiais didáticos atualizados para o concurso UFAC.
📢 Concursos Abertos para UFAC
Veja os concursos abertos da instituição UFAC. A lista está sempre atualizada:
🍀 Boa sorte e Bons Estudos,
ConcursosAZ - Aprovando de A a Z ✅
- #120195
- Banca
- UFAC
- Matéria
- Química
- Concurso
- UFAC
- Tipo
- Múltipla escolha
- Comentários
- Seja o primeiro a comentar
(1,0) 1 -
O etanoato de pentila está relacionado com o aroma da banana. A fórmula molecular deste flavorizante é:
- a)
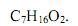
- b)
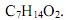
- c)

- d)

- e)
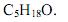
- #120196
- Banca
- UFAC
- Matéria
- Química
- Concurso
- UFAC
- Tipo
- Múltipla escolha
- Comentários
- Seja o primeiro a comentar
(1,0) 2 -
Classifique as seguintes moléculas em ordem decrescente de solubilidade em água:

- a) IV, I, V, II, III.
- b) III, II, I, V, IV.
- c) IV, V, I, II, III.
- d) I, V, II, III, IV.
- e) III, II,V, I, IV.
- #120197
- Banca
- UFAC
- Matéria
- Química
- Concurso
- UFAC
- Tipo
- Múltipla escolha
- Comentários
- Seja o primeiro a comentar
(1,0) 3 -
Considere que a seguinte reação da fotossíntese esteja em equilíbrio em uma célula vegetal:

A diminuição da concentração de oxigênio nas redondezas da célula:
- a) desloca o equilíbrio da esquerda para a direita, favorecendo a ocorrência da fotossíntese.
- b) aumenta a concentração de gás carbônico nas redondezas da célula.
- c) desloca o equilíbrio da esquerda para a direita, diminuindo a concentração de oxigênio.
- d) aumenta a concentração de água.
- e) não afetará o equilíbrio da reação.
- #120198
- Banca
- UFAC
- Matéria
- Química
- Concurso
- UFAC
- Tipo
- Múltipla escolha
- Comentários
- Seja o primeiro a comentar
(1,0) 4 -
Considerando o diagrama abaixo, qual das alternativas abaixo representa respectivamente o valor da energia de ativação e da energia do complexo ativado? Como essa reação pode ser classificada considerando as trocas de calor com o ambiente? A reação hipotética está indicada a seguir:

- a) 150 J, 120 J, reação exotérmica.
- b) 60 J, 180 J, reação endotérmica.
- c) 60 J, 120 J, reação endotérmica.
- d) 60 J, 180 J, reação exotérmica.
- e) 150 J, 120 J, reação endotérmica.
- #120199
- Banca
- UFAC
- Matéria
- Química
- Concurso
- UFAC
- Tipo
- Múltipla escolha
- Comentários
- Seja o primeiro a comentar
(1,0) 5 -
A equação química que ocorre em uma pilha está indicada abaixo:

O potencial total para essa pilha é:
- a) -0,42 V.
- b) -1,10 V.
- c) 0,42 V.
- d) 0,76 V.
- e) 1,10 V.
- #120200
- Banca
- UFAC
- Matéria
- Química
- Concurso
- UFAC
- Tipo
- Múltipla escolha
- Comentários
- Seja o primeiro a comentar
(1,0) 6 -
O açaí é uma fruta abundante na região Norte do país, intensivamente usada como fonte de alimentação devido ao seu alto teor energético e grande valor nutricional. Pesquisas recentes mostraram que na composição química do açaí são encontrados vários flavonóides com comprovada atividade antioxidante. A fórmula estrutural de uma dessas substâncias, a quercetina, é mostrada na figura a seguir:
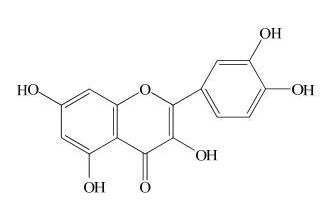
Dentre os grupos funcionais presentes na molécula de quercetina temos:
- a) fenol, cetona e aldeído.
- b) ácido carboxílico, cetona e éter.
- c) fenol, éter e cetona.
- d) álcool, aromático e éter.
- e) álcool, éster e cetona.
- #120201
- Banca
- UFAC
- Matéria
- Química
- Concurso
- UFAC
- Tipo
- Múltipla escolha
- Comentários
- Seja o primeiro a comentar
(1,0) 7 -
O aumento da concentração de

na atmosfera, resultante da queima de combustíveis orgânicos, contribui para a intensificação do efeito estufa e o conseqüente aumento no aquecimento global do planeta. A 25 °C, a queima do etanol e do metano libera 1.400 kJ/mol e 900 kJ/mol de energia, respectivamente. A razão entre a quantidade de energia liberada por mol de

emitido pela combustão do etanol e do metano são, respectivamente:
- a) 1.400 e 900 kJ/mol.
- b) 700 e 900 kJ/mol.
- c) 700 e 450 kJ/mol.
- d) 200 e 900 kJ/mol.
- e) 1.400 e 1.800 kJ/mol.
- #120202
- Banca
- UFAC
- Matéria
- Química
- Concurso
- UFAC
- Tipo
- Múltipla escolha
- Comentários
- Seja o primeiro a comentar
(1,0) 8 -
O dióxido de enxofre é um subproduto da queima de combustíveis fósseis, podendo combinar-se com a água para formar ácido sulfuroso. Alternativamente, o dióxido de enxofre pode reagir com o oxigênio da atmosfera para formar trióxido de enxofre, que por sua vez, forma em água, o ácido sulfúrico.
As reações de formação do dióxido de enxofre e do trióxido de enxofre e as respectivas variações de entalpia, ΔH, são:

A formação de trióxido de enxofre a partir do dióxido de enxofre é dada pela reação:

A alternativa que representa os valores indicados por x, y, z e w é:
- a) x = 1, y = 1, z = 1 e w = -99 kJ/mol.
- b) x = 1, y = 1/2, z = 1 e w = -99 kJ/mol.
- c) x = 1, y = 1/2, z = 1 e w = 99 kJ/mol.
- d) x = 1, y = 1/2, z = 1 e w = 693 kJ/mol.
- e) x = 1, y = 1, z = 1 e w = -693 kJ/mol.
- #120203
- Banca
- UFAC
- Matéria
- Química
- Concurso
- UFAC
- Tipo
- Múltipla escolha
- Comentários
- Seja o primeiro a comentar
(1,0) 9 -
Considerando os átomos abaixo, assinale a alternativa correta:

- a) A e B são isótopos e C e D são isótonos.
- b) B e C são isótopos e B e D são isóbaros.
- c) B e C são isóbaros e B e D são isótonos.
- d) C e D são isótopos e A e B são isótonos.
- e) A e D são isótonos e B e C são isóbaros.
- #120204
- Banca
- UFAC
- Matéria
- Química
- Concurso
- UFAC
- Tipo
- Múltipla escolha
- Comentários
- Seja o primeiro a comentar
(1,0) 10 -
Enquanto cozinhava em sua república, um estudante de Química deixou cair óleo no saleiro. Sabendo que o sal de cozinha não é solúvel em óleo, mas em água, o estudante realizou a recuperação do sal e do óleo seguindo os seguintes procedimentos:
- a) adição de água, decantação e destilação.
- b) adição de água, filtração e destilação.
- c) dissolução, decantação e sublimação.
- d) diluição, sedimentação e vaporização.
- e) decantação, filtração e destilação.
- #120205
- Banca
- UFAC
- Matéria
- Química
- Concurso
- UFAC
- Tipo
- Múltipla escolha
- Comentários
- Seja o primeiro a comentar
(1,0) 11 -
Os ácidos são substâncias químicas presentes no nosso dia-a-dia. Por exemplo, o ácido sulfúrico é muito utilizado na indústria petroquímica, na fabricação de papel, corantes, em baterias automotivas, entre outras diversas aplicações. Alguns sais derivados do ácido fosfórico são aplicados como fertilizantes na agricultura. Já o ácido muriático, poderoso agente de limpeza, nada mais é do que uma solução de ácido clorídrico. O ácido fluorídrico, um pouco menos conhecido, tem grande poder de atacar vidro e, por essa propriedade, é usado para gravação na parte inferior dos vidros de automóveis. Outro exemplo é a água boricada, que é uma solução aquosa de ácido bórico, normalmente usada como agente para assepsia. Enfim, é uma tarefa muito grande relacionar a importância e as aplicações dessas valiosas substâncias que não somente os químicos possuem acesso.
De acordo com o texto, a seqüência de fórmulas moleculares dos ácidos destacados, considerando a ordem de leitura, é:
- a) H2SO4, H3PO3, HCl, H2F e H3BO3.
- b) H2SO4, H3PO4, HCl, HF e H3BO4.
- c) H2SO3, H3PO3, H2Cl, H2F e H3BO3.
- d) H2SO4, H3PO4, HCl, H2F e H3BO3.
- e) H2SO4, H3PO4, HCl, HF e H3BO3.
- #120206
- Banca
- UFAC
- Matéria
- Química
- Concurso
- UFAC
- Tipo
- Múltipla escolha
- Comentários
- Seja o primeiro a comentar
(1,0) 12 -
Durante a Primeira Guerra Mundial, um bloqueio naval britânico impediu, estrategicamente, a remessa de salitre-do-chile para a Alemanha. Esse material, vindo de uma região desértica do norte do Chile, era partida para produção de explosivos, pois contém nitrato de sódio (NaNO3) , e era também responsável por dois terços da fabricação de fertilizantes no mundo, o que poderia prejudicar a produção de alimentos à época. A solução para tais problemas foi encontrada pelos trabalhos dos químicos alemães Fritz Haber e Carl Bosch, através de um processo onde são usados o nitrogênio atmosférico e o gás hidrogênio para produzir amoníaco (NH3), de forma economicamente viável, para a substituição do salitre. A equação química que representa esse processo é:
N2(g) + 3H2(g) ⇌ 2 NH3(g); ΔH < 0
Contudo, considerando em um determinado instante que o sistema esteja em equilíbrio, a produção de amoníaco será aumentada se:
- a) A temperatura do sistema for diminuída.
- b) Um catalisador for adicionado.
- c) A pressão do sistema for constante.
- d) Diminuir a quantidade de nitrogênio.
- e) O volume do sistema for aumentado.
- #120207
- Banca
- UFAC
- Matéria
- Química
- Concurso
- UFAC
- Tipo
- Múltipla escolha
- Comentários
- Seja o primeiro a comentar
(1,0) 13 -
Em laboratório, determinações simples como a temperatura de fusão e ebulição de uma substância são parâmetros que podem ajudar muito na identificação de amostras. Quando essas informações são associadas a outras propriedades elementares, como a solubilidade ou mesmo a miscibilidade em determinados solventes, o resultado da análise se torna mais confiável. Nesse sentido, de uma maneira geral, as substâncias polares possuem mais afinidade por outras polares e, por outro lado, as apolares por apolares. Essas propriedades são muito úteis na química orgânica, principalmente para comparar substâncias da mesma função e com diferentes tamanhos de cadeia carbônica.
A tabela a seguir, mostra as propriedades de cinco amostras enumeradas de I a V.

- a) etanol, n-hexano, 2-propanol, n-heptano e n-octano.
- b) n-heptano, etanol, n-hexano, 2-propanol e n-octano.
- c) etanol, 2-propanol, n-hexano, n-heptano e n-octano.
- d) n-hexano, 2-propanol, n-octano, etanol e n-heptano.
- e) n-hexano, 2-propanol, n-heptano, etanol e n-octano.
- #120208
- Banca
- UFAC
- Matéria
- Química
- Concurso
- UFAC
- Tipo
- Múltipla escolha
- Comentários
- Seja o primeiro a comentar
(1,0) 14 -
Na água sanitária comercial, o composto hipoclorito de sódio (NaClO) é o agente alvejante e desinfetante. Isso porque o íon hipoclorito é um forte oxidante capaz de remover manchas coloridas das roupas, através de reações de oxirredução. Contudo, o hipoclorito de sódio pode ser produzido pela reação entre o gás cloro e uma solução de hidróxido de sódio, conforme equação química a seguir:
2NaOH (aq) + Cl2(g) → NaClO(aq) + H2O(1)
Sobre o hipoclorito de sódio e a reação apresentada, é incorreto afirmar que:
- a) A equação química está balanceada.
- b) O número de oxidação do elemento cloro no hipoclorito de sódio é +1.
- c) Na substância cloro gasoso o número de oxidação do cloro é -1.
- d) No cloreto de sódio, outro produto da reação, o elemento cloro tem número de oxidação -1.
- e) Para cada 1 mol de NaOH que reage completamente, será produzido 0,5 mol de hipoclorito de sódio.
- #120209
- Banca
- UFAC
- Matéria
- Química
- Concurso
- UFAC
- Tipo
- Múltipla escolha
- Comentários
- Seja o primeiro a comentar
(1,0) 15 -
Em novembro de 1783, na presença do rei Luís XVI e da rainha Maria Antonieta, foi realizado em Paris o primeiro vôo tripulado em um balão inflado com ar quente. Poucos dias depois, em dezembro do mesmo ano, o químico francês Jacques Alexandre Cesar Charles (1746 – 1823), famoso por seus experimentos com balões, foi responsável pelo segundo vôo usando um gás muito mais leve que o ar – o hidrogênio, recém descoberto à época. Mesmo apresentando grande risco de explosão, porque esse gás é altamente inflamável, a aventura teve sucesso e o hidrogênio ainda foi usado por mais de 150 anos.
Imaginando-se que, para geração do hidrogênio, Charles usou cerca de 240,0 litros de solução aquosa de ácido clorídrico de concentração 12 mol.L-1 e 80,64 kg de ferro metálico puro, através da reação química representada pela equação:
Fe(s) + 2 HCl(aq) → FeCI2(aq) + H2(g)
Então, na temperatura de 25 ºC e pressão de 1 atm, o volume de gás hidrogênio, considerado gás ideal, para inflar o balão foi de aproximadamente:

- a) 3.000 L.
- b) 5.000 L.
- c) 15.000 L.
- d) 35.000 L.
- e) 70.000 L.

