Simulado UFTM | Técnico de Laboratório – Química | CONCURSO
📚 Simulado UFTM | Técnico de Laboratório - Química | cód.7751
Cada questão respondida é um passo rumo à aprovação. Bora pro simulado UFTM? 🏆
🎯 São milhares de simulados para concurso disponíveis para você praticar e conseguir a tão sonhada aprovação em Concurso Público.
🧪 Este Simulado UFTM foi elaborado da seguinte forma:
- 📌 Categoria: Concurso
- 🏛️ Instituição: UFTM
- 👔 Cargo: Técnico de Laboratório - Química
- 📚 Matéria: Química
- 🧩 Assuntos do Simulado:
- 🏢 Banca Organizadora: UFTM
- ❓ Quantidade de Questões: 20
- ⏱️ Tempo do Simulado: 60 minutos
⚙️ REGRA DO SIMULADO
Este simulado é gratuito 🆓. Basta clicar no botão iniciar abaixo e preencher um breve cadastro para participar do nosso ranking.
📊 No ranking você compara sua nota com outros candidatos e acompanha sua evolução nos estudos.
🚀 Aproveite este simulado UFTM e saia na frente na sua preparação!
📖 Questões UFTM
Se ainda não estiver pronto para fazer o simulado, treine antes com nossas questões de concursos:
🎥 Vídeo Aula
Confira vídeo aulas no YouTube com foco no concurso UFTM. Estude com conteúdo gratuito e atualizado.
Assistir vídeo aula sobre UFTM
📚 Apostila
Encontre apostilas completas e materiais didáticos atualizados para o concurso UFTM.
📢 Concursos Abertos para UFTM
Veja os concursos abertos da instituição UFTM. A lista está sempre atualizada:
🍀 Boa sorte e Bons Estudos,
ConcursosAZ - Aprovando de A a Z ✅
- #115012
- Banca
- UFTM
- Matéria
- Química
- Concurso
- UFTM
- Tipo
- Múltipla escolha
- Comentários
- Seja o primeiro a comentar
(1,0) 1 -
Gráficos de energia potencial para a formação de moléculas ou íons moleculares são bastante úteis, pois podem ser utilizados para a obtenção de parâmetros importantes como distância de ligação (DL) e energia de ligação. Observe o gráfico a seguir.
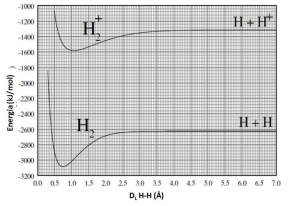
A partir das informações que podem ser extraídas do gráfico, é CORRETO afirmar que:
- a) As distâncias de ligação na molécula de hidrogênio e no seu íon molecular são iguais.
- b) As energias de ligação na molécula de hidrogênio e no seu íon molecular são iguais.
- c) A energia de ligação na molécula de hidrogênio é 2600 kJ mol-1 .
- d) A remoção de um elétron da molécula de H2 aumenta a distância de ligação em 0,25 Å.
- #115013
- Banca
- UFTM
- Matéria
- Química
- Concurso
- UFTM
- Tipo
- Múltipla escolha
- Comentários
- Seja o primeiro a comentar
(1,0) 2 -
A estrutura de uma molécula ou íon é descrita em função dos seus ângulos de ligação e comprimentos de ligação. Considere o dióxido de nitrogênio e seus respectivos íons NO2+ e NO2- .
Dado: N (Z = 7); O (Z = 8)
A ordem CRESCENTE dos ângulos de ligação O-N-O nessas espécies é:
- a) NO2 < NO2+ < NO2-
- b) NO2 + < NO2 < NO2-
- c) NO2- < NO2 + < NO2
- d) NO2- < NO2 < NO2+
- #115014
- Banca
- UFTM
- Matéria
- Química
- Concurso
- UFTM
- Tipo
- Múltipla escolha
- Comentários
- Seja o primeiro a comentar
(1,0) 3 -
A seguir estão representados 3 alcalóides com suas respectivas ações farmacológicas. Esses alcaloides apresentam fórmulas estruturais semelhantes.
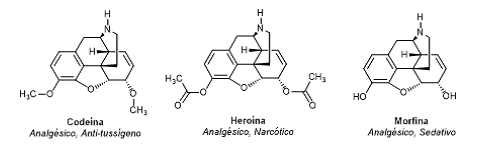
Os grupos funcionais presentes na codeína, heroína e morfina que diferenciam suas estruturas são respectivamente:
- a) Éter; Éster; Fenol e Amina.
- b) Éter; Éster; Fenol e Álcool.
- c) Éter; Éster; Álcool e Amina.
- d) Éter; Amina; Álcool e Éter.
- #115015
- Banca
- UFTM
- Matéria
- Química
- Concurso
- UFTM
- Tipo
- Múltipla escolha
- Comentários
- Seja o primeiro a comentar
(1,0) 4 -
O Estradiol, representado na figura a seguir, é um hormônio sexual feminino diretamente ligado à fertilidade da mulher. Como todo esteroide, é altamente solúvel em gorduras e apresenta uma estrutura básica de 17 átomos de carbono dispostos em quatro anéis ligados entre si, que formam diversos centros quirais.
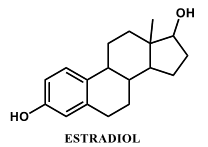
O número de centros quirais e o máximo de estereoisômeros presentes no estradiol são respectivamente:
- a) 5 e 32
- b) 6 e 64
- c) 4 e 16
- d) 3 e 8
- #115016
- Banca
- UFTM
- Matéria
- Química
- Concurso
- UFTM
- Tipo
- Múltipla escolha
- Comentários
- Seja o primeiro a comentar
(1,0) 5 -
A utilização de um determinado elemento químico requer o conhecimento de suas propriedades. Para materiais condutores, por exemplo, são utilizados elementos metálicos, os quais podem ser moldados na forma de fios. As propriedades dos elementos, entre elas a condutividade, estão ligadas à sua configuração eletrônica de valência, que, por sua vez, pode ser obtida a partir dos valores sucessivos de energia de ionização (E.I). A partir da configuração eletrônica de valência, pode-se determinar a qual grupo da tabela periódica um elemento representativo pertence. Uma grande variação relativa do valor da E.I indica que o elétron é retirado de uma camada mais interna e os anteriores, consequentemente, da camada de valência. Observe os Quadros 1 e 2.
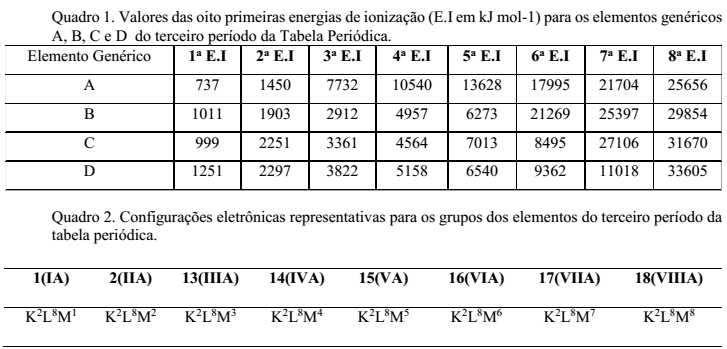
O elemento genérico adequado para obtenção de um fio condutor é:
- a) A
- b) B
- c) C
- d) D
- #115017
- Banca
- UFTM
- Matéria
- Química
- Concurso
- UFTM
- Tipo
- Múltipla escolha
- Comentários
- Seja o primeiro a comentar
(1,0) 6 -
Íons Ba2+(aq) são altamente tóxicos e suas soluções não podem ser descartadas na rede de esgoto. Esses íons devem, portanto, ser removidos de misturas que se pretende descartar, o que pode ser feito através de reações de precipitação. Para a remoção de íons Ba2+(aq) de 1,0 L de resíduo de concentração 0,01 mol L -1 foram propostos os seguintes procedimentos:
I. Adição de 0,1 L de solução de Na2CO3 0,1 mol L-1
II. Adição de 0,1 L de solução de Na2SO4 0,1 mol L-1
III. Adição de 0,1 L de solução de Na3PO4 0,01 mol L-1
IV. Adição de 0,1 L de solução de NaOH, 0,01 mol L-1
Dado: Constante do produto de solubilidade dos compostos de bário (Ks)
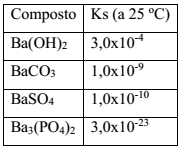
O procedimento que resulta na produção de um material mais adequado ao descarte é:
- a) I
- b) II
- c) III
- d) IV
- #115018
- Banca
- UFTM
- Matéria
- Química
- Concurso
- UFTM
- Tipo
- Múltipla escolha
- Comentários
- Seja o primeiro a comentar
(1,0) 7 -
Um frasco de ácido clorídrico concentrado contém 37% de HCl em massa e apresenta uma densidade de 1,20 g mL-1 . Foi transferido 5,00 mL de HCl desse frasco para um balão volumétrico de um litro e avolumado com água deionizada.
Qual o volume necessário dessa solução de HCl diluída para neutralizar 500 mL de NaOH 0,02 mol L-1 ?
- a) 45,3 mL
- b) 84,5 mL
- c) 164,5 mL
- d) 206,7 Ml
- #115019
- Banca
- UFTM
- Matéria
- Química
- Concurso
- UFTM
- Tipo
- Múltipla escolha
- Comentários
- Seja o primeiro a comentar
(1,0) 8 -
O ácido oxálico (H2C2O4 . 2H2O) é um ácido diprótico muito usado para fins analíticos, industriais e aplicações veterinárias. Uma amostra de 0,2520 g de um ácido oxálico foi pesada e titulada completamente com 25,00 mL de uma solução de NaOH de concentração 0,1200 mol L-1 .
Dado: H2C2O4 . 2H2O = 126 g mol-1
A porcentagem de pureza desse ácido é:
- a) 70 %
- b) 75 %
- c) 90 %
- d) 85 %
- #115020
- Banca
- UFTM
- Matéria
- Química
- Concurso
- UFTM
- Tipo
- Múltipla escolha
- Comentários
- Seja o primeiro a comentar
(1,0) 9 -
Espera-se que os laboratórios de controle de qualidade emitam laudos com valores que se aproximam o máximo possível do valor real. Para isso, os padrões devem ter o valor estabelecido o mais exato possível, qualquer erro ou incerteza no seu valor refletirá na qualidade dos resultados obtidos com as amostras desconhecidas. Com relação aos padrões primários é INCORRETO afirmar:
- a) O grau de pureza adequado para os materiais de referência primária é de 99,98%.
- b) Os padrões primários podem ser secados até 120°C sem sofrer alteração em sua composição.
- c) São exemplos de padrões primários: Na2CO3, NaCl, K2Cr2O7, Na2C2O4.
- d) Padrões primários podem ser compostos higroscópicos ou oxidáveis.
- #115021
- Banca
- UFTM
- Matéria
- Química
- Concurso
- UFTM
- Tipo
- Múltipla escolha
- Comentários
- Seja o primeiro a comentar
(1,0) 10 -
Potássio, fósforo e nitrogênio são os macronutrientes encontrados em praticamente todos os fertilizantes comerciais. A falta desses elementos limita o crescimento das plantas. O fósforo, por sua vez, é um elemento essencial para a produção de fosfolipídios e ATP, e esse elemento químico é absorvido pelas plantas sob a forma de sais, tais como NaH2PO4 e Na2HPO4. A absorção desses sais é mais eficiente quando o pH do solo está entre 5 e 8. Com o auxílio dessas informações, escolha a alternativa CORRETA
- a) Se o pH diminuir, o equilíbrio da primeira ionização do ácido fosfórico será deslocado para a direita.
- b) O nome do sal Na2HPO4 é dihidrogenofosfato de sódio.
- c) Se a concentração de íons H+ no solo for igual a 1,0×10-7mol L-1 , a absorção dos íons fósforo ocorrerá com a máxima eficiência.
- d) O sal Na2HPO4 pode ser obtido pela seguinte reação balanceada: H3PO4 + NaOH → Na2HPO4 + H2O.
- #115022
- Banca
- UFTM
- Matéria
- Química
- Concurso
- UFTM
- Tipo
- Múltipla escolha
- Comentários
- Seja o primeiro a comentar
(1,0) 11 -
Soluções fortemente alcalinas e o ácido fluorídrico necessitam ser acondicionados em frascos de:
- a) Plástico, como o polietileno de alta densidade.
- b) Metal, como o alumínio anodizado.
- c) Vidro, como o borossilicato.
- d) Porcelana, como a porcelana esmaltada.
- #115023
- Banca
- UFTM
- Matéria
- Química
- Concurso
- UFTM
- Tipo
- Múltipla escolha
- Comentários
- Seja o primeiro a comentar
(1,0) 12 -
Uma das formas de produção da amônia é a partir da reação entre a cal viva (óxido de cálcio) e o cloreto de amônio, conforme reação a seguir:
CaO(s) + 2 NH4Cl(s) → 2 NH3(g) + H2O(g) + CaCl2(s)
10 g de uma amostra de cal viva foram colocados para reagir com excesso de cloreto de amônio e foram produzidos 5 g de amônia. Qual a porcentagem de óxido de cálcio dessa amostra de cal viva?
Dados: CaO (56 g mol-1 )
NH4Cl (53,5 g mol-1 )
NH3 (17 g mol-1 )
H2O (18 g mol-1 )
CaCl2 (111 g mol-1 )
- a) 60%
- b) 73%
- c) 82%
- d) 90%
- #115024
- Banca
- UFTM
- Matéria
- Química
- Concurso
- UFTM
- Tipo
- Múltipla escolha
- Comentários
- Seja o primeiro a comentar
(1,0) 13 -
Uma _______________________ constitui uma excelente solução para a neutralização de soluções ácidas para descarte, pois além de elevar o pH, promove a formação de bolhas atóxicas que, quando cessadas, possibilitam que o usuário perceba que o meio já se encontra em pH próximo ao neutro.
A alternativa que completa a frase de forma CORRETA é:
- a) Solução saturada de hidróxido de potássio.
- b) Solução diluída de acetato de amônio.
- c) Solução diluída de hidróxido de amônio.
- d) Solução saturada de carbonato de sódio.
- #115025
- Banca
- UFTM
- Matéria
- Química
- Concurso
- UFTM
- Tipo
- Múltipla escolha
- Comentários
- Seja o primeiro a comentar
(1,0) 14 -
O cloreto de titânio(IV), TiCl4, é um importante produto químico industrial. Esse pode ser usado tanto na obtenção do TiO2 quanto de titânio metálico. O TiCl4 pode ser obtido a partir de um minério contendo titânio (TiO2 impuro), utilizado em excesso, com carbono e gás cloro, conforme a equação química a seguir.
TiO2(s) + 2 Cl2(g) + C(s) → TiCl4(l) + CO2(g)
Considere que a obtenção do TiCl4 seja feita a partir de 852 g de C e 852 g de Cl2.
Dados: Cl2 (71 g mol-1 ); C (12 g mol-1 ) e TiCl4 (190 g mol-1 )
O reagente limitante e a massa em gramas de TiCl4 obtida são, respectivamente:
- a) Cl2 e 2280 g
- b) C e 71 g
- c) Cl2 e 1140 g
- d) C e 13490 g
- #115026
- Banca
- UFTM
- Matéria
- Química
- Concurso
- UFTM
- Tipo
- Múltipla escolha
- Comentários
- Seja o primeiro a comentar
(1,0) 15 -
Acerca das teorias ácido-base e tampão são feitas as seguintes afirmações:
I. Segundo a teoria de Arrhenius ácidos e bases são classificados segundo sua capacidade de doar e receber prótons.
II. Quanto maior o valor da constante de ionização de uma base, maior será o valor do pH da solução.
III. Para uma solução de amônia que apresenta concentração dos íons OH- igual a 10-3 mol L-1, o pH é igual a 3.
IV. Um sistema tampão pode ser formado por um ácido forte e sua base conjugada.
V. Dobrando a concentração de ácido e sua base conjugada, que formam a solução tampão, o pH permanece constante, porém o poder tamponante aumenta.
É CORRETO o que se afirma em:
- a) II e V
- b) II e III
- c) II, IV e V
- d) III e V

