Simulado UFG de Quimica | VESTIBULAR
📚 Simulado UFG | Vestibular | cód.8095
Seu futuro começa com uma escolha: treinar de verdade. E o simulado UFG é o primeiro passo! 🏁
🎯 São milhares de simulados para concurso disponíveis para você praticar e conseguir a tão sonhada aprovação em Concurso Público.
🧪 Este Simulado UFG foi elaborado da seguinte forma:
- 📌 Categoria: Vestibular
- 🏛️ Instituição: UFG
- 👔 Cargo: Vestibular
- 📚 Matéria: Química
- 🧩 Assuntos do Simulado:
- 🏢 Banca Organizadora: CS-UFG
- ❓ Quantidade de Questões: 20
- ⏱️ Tempo do Simulado: 60 minutos
⚙️ REGRA DO SIMULADO
Este simulado é gratuito 🆓. Basta clicar no botão iniciar abaixo e preencher um breve cadastro para participar do nosso ranking.
📊 No ranking você compara sua nota com outros candidatos e acompanha sua evolução nos estudos.
🚀 Aproveite este simulado UFG e saia na frente na sua preparação!
📖 Questões UFG
Se ainda não estiver pronto para fazer o simulado, treine antes com nossas questões de concursos:
🎥 Vídeo Aula
Confira vídeo aulas no YouTube com foco no concurso UFG. Estude com conteúdo gratuito e atualizado.
📚 Apostila
Encontre apostilas completas e materiais didáticos atualizados para o concurso UFG.
📢 Concursos Abertos para UFG
Veja os concursos abertos da instituição UFG. A lista está sempre atualizada:
🍀 Boa sorte e Bons Estudos,
ConcursosAZ - Aprovando de A a Z ✅
- #120892
- Banca
- CS-UFG
- Matéria
- Química
- Concurso
- UFG
- Tipo
- Múltipla escolha
- Comentários
- Seja o primeiro a comentar
(1,0) 1 -
Na maioria dos alcanos, o aumento da massa molecular eleva a temperatura de ebulição de suas moléculas. Entretanto, quando se trata de isômeros, a análise da estrutura química desses compostos permite comparar as suas temperaturas de ebulição. Alguns alcanos que são isômeros constitucionais estão mostrados a seguir.

Dentre os compostos apresentados, o que apresenta a menor temperatura de ebulição é o
- a) 2,3,3-trimetil-pentano.
- b) 2,4-dimetil-hexano
- c) 3-metil-heptano.
- d) 2-metil-heptano.
- e) n-octano.
- #120895
- Banca
- CS-UFG
- Matéria
- Química
- Concurso
- UFG
- Tipo
- Múltipla escolha
- Comentários
- Seja o primeiro a comentar
(1,0) 2 -
O sulfato de bário, por ser insolúvel em água e não ser absorvido pelos tecidos, é muito utilizado como um meio de contraste em exames radiológicos. Ele funciona como um marcador tecidual que permite verificar a integridade da mucosa de todo o trato gastrointestinal, delineando cada segmento. Sua síntese pode ser realizada a partir da equação a seguir
BaCl2 (s) + Na2 SO4 (aq) → BaSO4 (s) + 2NaCl(aq)
Massas Molares (g.mol -1 )
BaCl2= 208
Na2SO4 = 142
BaSO4 = 233
NaCl = 58,5
Se 5,2 g de BaCl2 são misturados com 5,0 g de Na2SO4, a massa aproximada de BaSO4 obtida, em gramas, será de
- a) 5,8
- b) 6,7
- c) 7,7
- d) 8,2
- e) 8,8
- #120897
- Banca
- CS-UFG
- Matéria
- Química
- Concurso
- UFG
- Tipo
- Múltipla escolha
- Comentários
- Seja o primeiro a comentar
(1,0) 3 -
Um composto orgânico desconhecido foi submetido a análise química na qual constatou-se tratar de um alcano que apresentava seis átomos de carbono.
O número máximo de compostos que poderia corresponder ao composto orgânico em questão é igual a
- a) 3
- b) 4
- c) 5
- d) 6
- e) 7
- #120899
- Banca
- CS-UFG
- Matéria
- Química
- Concurso
- UFG
- Tipo
- Múltipla escolha
- Comentários
- Seja o primeiro a comentar
(1,0) 4 -
Na maioria dos alcanos, o aumento da massa molecular eleva a temperatura de ebulição de suas moléculas. Entretanto, quando se trata de isômeros, a análise da estrutura química desses compostos permite comparar as suas temperaturas de ebulição. Alguns alcanos que são isômeros constitucionais estão mostrados a seguir.

Dentre os compostos apresentados, o que apresenta a menor temperatura de ebulição é o
- a) 2,3,3-trimetil-pentano.
- b) 2,4-dimetil-hexano.
- c) 3-metil-heptano.
- d) 2-metil-heptano.
- e) n-octano.
- #120909
- Banca
- CS-UFG
- Matéria
- Química
- Concurso
- UFG
- Tipo
- Múltipla escolha
- Comentários
- Seja o primeiro a comentar
(1,0) 5 -
A solubilidade da maioria dos solutos sólidos aumenta à medida que a temperatura da solução se eleva. Esse comportamento pode ser previsto através da representação gráfica da solubilidade das diversas espécies químicas em função da temperatura, como mostrado na figura a seguir.
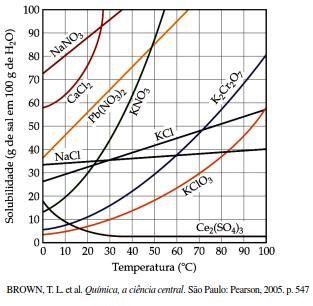
De acordo com o gráfico, quando uma solução de KClO3 for preparada pela dissolução de 70 g do sal em 250 g de água a uma temperatura de 70 °C e, em seguida, o sistema for resfriado até a temperatura de 30 °C, a massa, em gramas, do sal que precipitará será de, aproximadamente,
- a) 10
- b) 25
- c) 30
- d) 45
- e) 50
- #120912
- Banca
- CS-UFG
- Matéria
- Química
- Concurso
- UFG
- Tipo
- Múltipla escolha
- Comentários
- Seja o primeiro a comentar
(1,0) 6 -
A vanilina é um composto orgânico aromático que confere o sabor de baunilha aos alimentos e apresenta a estrutura química mostrada a seguir.

Nessa molécula, encontra-se presente o grupo funcional característico de um(a)
- a) éster.
- b) fenol.
- c) imina.
- d) álcool.
- e) cetona.
- #120913
- Banca
- CS-UFG
- Matéria
- Química
- Concurso
- UFG
- Tipo
- Múltipla escolha
- Comentários
- Seja o primeiro a comentar
(1,0) 7 -
Para adquirir estabilidade, os elementos químicos perdem ou ganham elétrons se transformando em íons positivos ou negativos que apresentam configurações eletrônicas de gases nobres. Um exemplo desse processo está representado a seguir.
Cl + e- → Cl-
Na - e- → Na+
Como resultado dessas transferências de elétrons, os raios iônicos das espécies Cl - e Na+ , quando comparado com seus respectivos raios atômicos, irão, respectivamente
- a) diminuir e aumentar.
- b) aumentar e diminuir.
- c) aumentar e permanecer constante.
- d) permanecer constante e diminuir.
- e) diminuir e permanecer constante.
- #120915
- Banca
- CS-UFG
- Matéria
- Química
- Concurso
- UFG
- Tipo
- Múltipla escolha
- Comentários
- Seja o primeiro a comentar
(1,0) 8 -
O sulfato de bário, por ser insolúvel em água e não ser absorvido pelos tecidos, é muito utilizado como um meio de contraste em exames radiológicos. Ele funciona como um marcador tecidual que permite verificar a integridade da mucosa de todo o trato gastrointestinal, delineando cada segmento. Sua síntese pode ser realizada a partir da equação a seguir
BaCl2(s) + Na2SO4(aq) → BaSO4(s) + 2NaCl(aq)
Se 5,2 g de BaCl2 são misturados com 5,0 g de Na2SO4, a massa aproximada de BaSO4 obtida, em gramas, será de
Massas Molares (g.mol-1 )
BaCl2 = 208
Na2 SO4 = 142
BaSO4 = 233
NaCl = 58,5
- a) 5,8
- b) 6,7
- c) 7,7
- d) 8,2
- e) 8,8
- #120918
- Banca
- CS-UFG
- Matéria
- Química
- Concurso
- UFG
- Tipo
- Múltipla escolha
- Comentários
- Seja o primeiro a comentar
(1,0) 9 -
A fórmula mínima ou fórmula empírica de um composto indica a menor proporção de números inteiros de átomos constituintes de uma substância. A aspirina, um composto formado por C, H e O contém 60,0% de C em massa. Se 18,00 g do composto contém 4,82 x 1023 átomos de H, a fórmula empírica do composto será
- a) C3H4O2
- b) C5H4O2
- c) C6H8O3
- d) C7H8O4
- e) C9H8O4
- #120922
- Banca
- CS-UFG
- Matéria
- Química
- Concurso
- UFG
- Tipo
- Múltipla escolha
- Comentários
- Seja o primeiro a comentar
(1,0) 10 -
A síntese da amônia é determinada pelo processo de Haber-Bosch e a sua equação química não balanceada está mostrada a seguir.
N2(g) + H2(g)

NH3(g)
Em uma mistura dos três gases, a 480 °C, a constante de equilíbrio é, aproximadamente, igual a 1,5 x 10-5 . Supondo-se que as pressões parciais de N2 e de H2 sejam iguais a 0,6 e 1,0 atm, respectivamente, a pressão parcial de NH3 nessa mistura em equilíbrio, em atm, é igual a
- a) 1,6 x 10-3
- b) 2,6 x 10-3
- c) 3,0 x 10-3
- d) 9,0 x 10-3
- e) 8,0 x 10-2
- #120924
- Banca
- CS-UFG
- Matéria
- Química
- Concurso
- UFG
- Tipo
- Múltipla escolha
- Comentários
- Seja o primeiro a comentar
(1,0) 11 -
A calorimetria pode ser utilizada para determinar a quantidade de calor necessária para promover a mudança de estado físico de substâncias puras. O etanol puro apresenta densidade de, aproximadamente, 0,80 g.mL-1 e entra em ebulição à 78 °C. A capacidade calorífica específica do etanol líquido é 2,40 J.g-1 .K-1 , e sua entalpia de vaporização é 856 J.g -1 . De acordo com os dados apresentados, a quantidade de energia térmica, em kJ, necessária para que 0,625 L de etanol líquido a 20 °C passe totalmente para o estado gasoso a 78 °C é, aproximadamente, igual a
- a) 124
- b) 249
- c) 374
- d) 498
- e) 547
- #120925
- Banca
- CS-UFG
- Matéria
- Química
- Concurso
- UFG
- Tipo
- Múltipla escolha
- Comentários
- Seja o primeiro a comentar
(1,0) 12 -
Soluções são preparadas a partir da dissolução de um soluto em um solvente e suas concentrações podem ser determinadas em termos de molalidade (m), que é a quantidade de matéria de soluto presente em uma determinada massa de solvente, em quilogramas. Uma solução de ácido sulfúrico contendo 490 g de soluto por litro de solução apresenta densidade de 1,29 g.mL-1 . A molalidade dessa solução é igual a
- a) 1,25 m.
- b) 2,50 m.
- c) 3,75 m.
- d) 5,00 m
- e) 6,25 m.
- #120926
- Banca
- CS-UFG
- Matéria
- Química
- Concurso
- UFG
- Tipo
- Múltipla escolha
- Comentários
- Seja o primeiro a comentar
(1,0) 13 -
Analisando o diagrama de fases da água, conclui-se que é possível liquefazer o gelo por aumento de pressão. A 1,0 atm e -4 °C, por exemplo, essa pressão é da ordem de 140 atm. Esse processo é apresentado, através de um modelo simplificado, em livros didáticos do ensino médio, quando se considera, por exemplo, que um patinador desliza no gelo com base apenas nesse fenômeno.
Desse modo, considere um patinador sobre o gelo usando um patim conforme a especificação da figura abaixo

e admita que a espessura do metal em contato com o gelo é de 1,0 mm.
Com base nas informações acima, calcule a massa, em kg, que o patinador deve ter, de modo a liquefazer o gelo por pressão, e confirme se o modelo é, ou não, adequado.

- a) 11, não
- b) 40, sim.
- c) 80, sim.
- d) 140, não.
- e) 280, não.
- #120927
- Banca
- CS-UFG
- Matéria
- Química
- Concurso
- UFG
- Tipo
- Múltipla escolha
- Comentários
- Seja o primeiro a comentar
(1,0) 14 -
A borracha de silicone MQ é um polimetilsiloxano que contém grupos metila, conforme a figura abaixo.

Com a introdução de alguns grupos vinila na molécula de MQ obtém-se a borracha metil-vinil-siliconada, VMQ.

A borracha VMQ vulcaniza mais rapidamente que a borra- cha MQ como consequência
- a) do aumento das unidades monoméricas.
- b) da alternância entre grupos metil e vinil na cadeia polimérica.
- c) da introdução de insaturação no polímero.
- d) da maior massa molar do polímero VMQ.
- e) dos encadeamentos lineares.
- #120931
- Banca
- CS-UFG
- Matéria
- Química
- Concurso
- UFG
- Tipo
- Múltipla escolha
- Comentários
- Seja o primeiro a comentar
(1,0) 15 -
As relações entre os produtos e os reagentes da reação química

podem ser descritas como relações de conjuntos matemáticos. Considere o conjunto domínio CO, formado pelos isótopos 12 C e 13 C, e o conjunto imagem formado pelo produto

. Desse modo, com base na relação entre o domínio e a imagem, pode-se concluir que
- a) cada elemento do domínio corresponde a um elemento da imagem
- b) cada elemento da imagem corresponde a dois elementos do domínio.
- c) cada elemento do domínio corresponde a dois ele- mentos da imagem
- d) cada elemento da imagem corresponde a três elementos do domínio.
- e) cada elemento do domínio corresponde a três elementos da imagem.

