Simulado IF/RN - Química | CONCURSO
📚 Simulado IFRN | Técnico - Química | cód.3931
Pronto para o desafio? Comece com este simulado IFRN! 🔍
🎯 São milhares de simulados para concurso disponíveis para você praticar e conseguir a tão sonhada aprovação em Concurso Público.
🧪 Este Simulado IFRN foi elaborado da seguinte forma:
- 📌 Categoria: Concurso
- 🏛️ Instituição: IFRN
- 👔 Cargo: Técnico - Química
- 📚 Matéria: Química
- 🧩 Assuntos do Simulado:
- 🏢 Banca Organizadora: FUNCERN
- ❓ Quantidade de Questões: 12
- ⏱️ Tempo do Simulado: 36 minutos
⚙️ REGRA DO SIMULADO
Este simulado é gratuito 🆓. Basta clicar no botão iniciar abaixo e preencher um breve cadastro para participar do nosso ranking.
📊 No ranking você compara sua nota com outros candidatos e acompanha sua evolução nos estudos.
🚀 Aproveite este simulado IFRN e saia na frente na sua preparação!
📖 Questões IFRN
Se ainda não estiver pronto para fazer o simulado, treine antes com nossas questões de concursos:
🎥 Vídeo Aula
Confira vídeo aulas no YouTube com foco no concurso IFRN. Estude com conteúdo gratuito e atualizado.
Assistir vídeo aula sobre IFRN
📚 Apostila
Encontre apostilas completas e materiais didáticos atualizados para o concurso IFRN.
📢 Concursos Abertos para IFRN
Veja os concursos abertos da instituição IFRN. A lista está sempre atualizada:
🍀 Boa sorte e Bons Estudos,
ConcursosAZ - Aprovando de A a Z ✅
- #43528
- Banca
- FUNCERN
- Matéria
- Química
- Concurso
- IFRN
- Tipo
- Múltipla escolha
- Comentários
- Seja o primeiro a comentar
(1,0) 1 -
- a) 3 componentes e 3 fases.
- b) 4 componentes e 3 fases.
- c) 3 componentes e 2 fases.
- d) 4 componentes e 2 fases.
- #43529
- Banca
- FUNCERN
- Matéria
- Química
- Concurso
- IFRN
- Tipo
- Múltipla escolha
- Comentários
- Seja o primeiro a comentar
(1,0) 2 -
Um aluno verificou no laboratório de química, por meio de um pH-metro, que a polpa integral de acerola possui pH = 4. Ele resolveu adicionar 20 mL dessa polpa a 180 mL de água para fazer um suco de acerola.
Ao final, ele obteve um suco com concentração hidrogeniônica de
- a) 10-6 mol/L.
- b) 10-5 mol/L.
- c) 10-4 mol/L.
- d) 10-3 mol/L.
- #43530
- Banca
- FUNCERN
- Matéria
- Química
- Concurso
- IFRN
- Tipo
- Múltipla escolha
- Comentários
- Seja o primeiro a comentar
(1,0) 3 -
O aspartame, representado pela fórmula estrutural abaixo, é um adoçante artificial 170 vezes mais doce que a sacarose quando diluído em água. A ingestão, por dia, de 5 g desse adoçante, por uma pessoa de aproximadamente 70 kg, pode provocar intoxicações e distúrbios neurológicos.
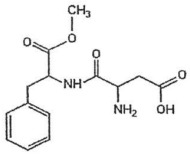
Fonte: FUNCERN, 2015.
Sabendo que a fórmula molecular da sacarose é C12H22O11, a quantidade de sacarose que corresponderá a 5 g de aspartame é
- a) 1x10-1 mol.
- b) 1x10-2 mol.
- c) 1x10-3 mol.
- d) 1x10-4 mol.
- #43531
- Banca
- FUNCERN
- Matéria
- Química
- Concurso
- IFRN
- Tipo
- Múltipla escolha
- Comentários
- Seja o primeiro a comentar
(1,0) 4 -
Um técnico em química do IFRN coletou uma amostra de vinagre no comércio de Natal para analisar a acidez com 4 repetições e obteve os seguintes valores de ácido acético: 6,20%, 6,21%, 6,19% e 6,20%.
Considerando que o teor máximo de acidez do vinagre é de 6,00% de ácido acético, os valores obtidos na análise são
- a) exatos e imprecisos.
- b) exatos e precisos.
- c) inexatos e precisos.
- d) inexatos e imprecisos.
- #43532
- Banca
- FUNCERN
- Matéria
- Química
- Concurso
- IFRN
- Tipo
- Múltipla escolha
- Comentários
- Seja o primeiro a comentar
(1,0) 5 -
Considere as equações termoquímicas abaixo.
I) CO2(g) ? C(grafite) + O2(g) ?H1 = 94 kcal
II) H2(g) + 1/2O2(g) ? H2O(l) ?H2 = – 78 kcal
III) CH4(g) + 2O2(g) ? CO2(g) + 2H2O(l) ?H3 = – 222 kcal
IV) C(grafite) + 2H2(g) ? CH4(g) ?H4 = ?
Com base nessas informações,
- a) ΔH4 = – 28 kcal, caracterizando uma reação endotérmica.
- b) ΔH4 = – 28 kcal, caracterizando uma reação exotérmica.
- c) ΔH4 = – 206 kcal, caracterizando uma reação endotérmica.
- d) ΔH4 = – 206 kcal, caracterizando uma reação exotérmica.
- #43533
- Banca
- FUNCERN
- Matéria
- Química
- Concurso
- IFRN
- Tipo
- Múltipla escolha
- Comentários
- Seja o primeiro a comentar
(1,0) 6 -
Observe os elementos químicos abaixo:
X: 1s2 , 2s2 , 2p6 , 3s2 , 3p6 , 4s2 , 3d10
Y: 1s2 , 2s2 , 2p6 , 3s2 , 3p6 , 4s2 , 3d10, 4p6 , 5s2 , 4d10, 5p6 , 6s1
Z: 1s2 , 2s2 , 2p6 , 3s2 , 3p5
W: 1s2 , 2s2 , 2p6 , 3s2 , 3p6 , 4s2 , 3d10, 4p6 , 5s1
Com relação às propriedades dos átomos,
- a) X é um elemento de transição interna que se localiza no terceiro período da Tabela Periódica.
- b) O elemento Y possui maior raio atômico e maior energia de ionização.
- c) O elemento W pertence à família dos metais alcalinos terrosos.
- d) Z é o elemento representativo que possui maior energia de ionização.
- #43534
- Banca
- FUNCERN
- Matéria
- Química
- Concurso
- IFRN
- Tipo
- Múltipla escolha
- Comentários
- Seja o primeiro a comentar
(1,0) 7 -
Em um laboratório de química, há uma solução preparada de ácido oxálico (H2C2O4) em concentração molar (M).
A relação entre a concentração normal (N) e concentração molar (M) para esse ácido é
- a) N = 1/2M.
- b) N = M.
- c) N = 2M.
- d) N = 3M.
- #43535
- Banca
- FUNCERN
- Matéria
- Química
- Concurso
- IFRN
- Tipo
- Múltipla escolha
- Comentários
- Seja o primeiro a comentar
(1,0) 8 -
Considere a figura abaixo que representa a fórmula estrutural do eugenol, um composto orgânico extraído do cravo da índia.

Fonte: FUNCERN, 2015.
Com base nessas informações, é correto afirmar que o eugenol possui
- a) um grupo funcional carboxila.
- b) dois carbonos terciários e três secundários.
- c) cadeia homogênea e saturada.
- d) fórmula molecular C10H12O2.
- #43536
- Banca
- FUNCERN
- Matéria
- Química
- Concurso
- IFRN
- Tipo
- Múltipla escolha
- Comentários
- Seja o primeiro a comentar
(1,0) 9 -
- a) a osmoscopia estuda o abaixamento do ponto de solidificação do solvente, causado pela adição de um soluto não volátil.
- b) a ebulioscopia estuda a passagem espontânea de solvente de uma solução mais diluída para outra mais concentrada através de membranas semipermeáveis.
- c) a tonoscopia estuda o abaixamento da pressão máxima de vapor de um solvente, causado pela adição de um soluto não volátil.
- d) a crioscopia estuda o aumento do ponto de ebulição do solvente, causado pela adição de um soluto não volátil.
- #43537
- Banca
- FUNCERN
- Matéria
- Química
- Concurso
- IFRN
- Tipo
- Múltipla escolha
- Comentários
- Seja o primeiro a comentar
(1,0) 10 -
Considere a reação genérica A + B ? C. Após uma série de experimentos, observou-se que:
• dobrando a concentração de A, a velocidade de formação de C duplica; e
• dobrando a concentração de B, a velocidade de reação de C quadruplica.
Com base nessas informações,
- a) a constante de equilíbrio é dada por Kc = [C]/[A]2 [B].
- b) a reação é de neutralização.
- c) a velocidade de reação é dada por v = k[A][B].
- d) a reação é de terceira ordem.
- #43538
- Banca
- FUNCERN
- Matéria
- Química
- Concurso
- IFRN
- Tipo
- Múltipla escolha
- Comentários
- Seja o primeiro a comentar
(1,0) 11 -
Um gás ideal foi submetido a três processos (1 ? 2, 2 ? 3, 3 ? 1), como observado no gráfico abaixo.
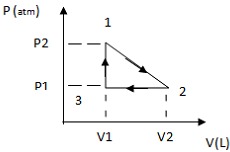
Fonte: FUNCERN, 2015
Com base nas informações do gráfico,
- a) o processo 2 → 3 representa um processo isobárico.
- b) o trabalho correspondente ao processo 2 → 3 é igual a zero.
- c) o processo 3 → 1 representa um processo isotérmico.
- d) o trabalho correspondente ao processo 3 → 1 é diferente de zero.
- #43539
- Banca
- FUNCERN
- Matéria
- Química
- Concurso
- IFRN
- Tipo
- Múltipla escolha
- Comentários
- Seja o primeiro a comentar
(1,0) 12 -
As substâncias químicas abaixo possuem características próprias que podem sofrer modificações, à medida que interagem entre si e com outras substâncias.
NaOH HF HC SiC Fe
Com relação a essas substâncias, é correto afirmar:
- a) o hidróxido de sódio e o ácido clorídrico possuem ligações iônicas entre os átomos, o que explica a forte condução elétrica quando dissolvidos em água.
- b) o ácido fluorídrico é formado pela ligação covalente muito forte entre os átomos de hidrogênio e flúor em função das interações das forças de Van der Waals, o que explica sua alta polaridade.
- c) o carbeto de silício é um sólido muito duro, possui alto ponto de fusão e é mau condutor de energia elétrica e térmica, características que se explicam pela ligação covalente entre seus átomos.
- d) o ferro é um metal que tem boa condutividade elétrica, cujas ligações entre os átomos são formadas por um mar de elétrons, denominadas ligações iônicas.

