Simulado ENEM | QUÍMICA | ENEM
📚 Simulado ENEM | Aluno ENEM | cód.6388
Você está a um simulado de distância da sua melhor versão. Treine para o concurso ENEM! 💡
🎯 São milhares de simulados para concurso disponíveis para você praticar e conseguir a tão sonhada aprovação em Concurso Público.
🧪 Este Simulado ENEM foi elaborado da seguinte forma:
- 📌 Categoria: Enem
- 🏛️ Instituição: ENEM
- 👔 Cargo: Aluno ENEM
- 📚 Matéria: Química
- 🧩 Assuntos do Simulado:
- 🏢 Banca Organizadora: INEP
- ❓ Quantidade de Questões: 20
- ⏱️ Tempo do Simulado: 60 minutos
⚙️ REGRA DO SIMULADO
Este simulado é gratuito 🆓. Basta clicar no botão iniciar abaixo e preencher um breve cadastro para participar do nosso ranking.
📊 No ranking você compara sua nota com outros candidatos e acompanha sua evolução nos estudos.
🚀 Aproveite este simulado ENEM e saia na frente na sua preparação!
📖 Questões ENEM
Se ainda não estiver pronto para fazer o simulado, treine antes com nossas questões de concursos:
🎥 Vídeo Aula
Confira vídeo aulas no YouTube com foco no concurso ENEM. Estude com conteúdo gratuito e atualizado.
Assistir vídeo aula sobre ENEM
📚 Apostila
Encontre apostilas completas e materiais didáticos atualizados para o concurso ENEM.
📢 Concursos Abertos para ENEM
Veja os concursos abertos da instituição ENEM. A lista está sempre atualizada:
🍀 Boa sorte e Bons Estudos,
ConcursosAZ - Aprovando de A a Z ✅
- #88684
- Banca
- INEP
- Matéria
- Química
- Concurso
- ENEM
- Tipo
- Múltipla escolha
- Comentários
- Seja o primeiro a comentar
(1,0) 1 -
Sobre a diluição do ácido sulfúrico em água, o químico e escritor Primo Levi afirma que, “está escrito em todos os tratados, é preciso operar às avessas, quer dizer, verter o ácido na água e não o contrário, senão aquele líquido oleoso de aspecto tão inócuo está sujeito a iras furibundas: sabem-no até os meninos do ginásio”.
(furibundo: adj. furioso)
LEVI, P A tabela periódica. Rio de Janeiro: Relume-Dumará, 1994 (adaptado).
O alerta dado por Levi justifica-se porque a
- a) diluição do ácido libera muito calor.
- b) mistura de água e ácido é explosiva.
- c) água provoca a neutralização do ácido.
- d) mistura final de água e ácido separa-se em fases.
- e) água inibe a liberação dos vapores provenientes do ácido.
- #88689
- Banca
- INEP
- Matéria
- Química
- Concurso
- ENEM
- Tipo
- Múltipla escolha
- Comentários
- Seja o primeiro a comentar
(1,0) 2 -
O elemento radioativo tório (Th) pode substituir os combustíveis fósseis e baterias. Pequenas quantidades desse elemento seriam suficientes para gerar grande quantidade de energia. A partícula liberada em seu decaimento poderia ser bloqueada utilizando-se uma caixa de aço inoxidável. A equação nuclear para o decaimento do![]() é:
é:
![]()
Considerando a equação de decaimento nuclear, a partícula que fica bloqueada na caixa de aço inoxidável é o(a)
- a) alfa.
- b) beta.
- c) próton.
- d) nêutron.
- e) pósitron.
- #88695
- Banca
- INEP
- Matéria
- Química
- Concurso
- ENEM
- Tipo
- Múltipla escolha
- Comentários
- Seja o primeiro a comentar
(1,0) 3 -
Várias características e propriedades de moléculas orgânicas podem ser inferidas analisando sua fórmula estrutural. Na natureza, alguns compostos apresentam a mesma fórmula molecular e diferentes fórmulas estruturais. São os chamados isômeros, como ilustrado nas estruturas.
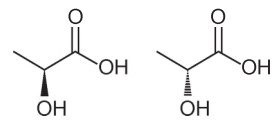
Entre as moléculas apresentadas, observa-se a ocorrência de isomeria
- a) ótica.
- b) de função.
- c) de cadeia.
- d) geométrica.
- e) de compensação.
- #88697
- Banca
- INEP
- Matéria
- Química
- Concurso
- ENEM
- Tipo
- Múltipla escolha
- Comentários
- Seja o primeiro a comentar
(1,0) 4 -
O fitato, presente em diversos cereais, apresenta a propriedade de associar-se a alguns minerais, proteínas e carboidratos, formando complexos insolúveis e incapazes de serem digeridos por animais monogástricos. Por esse motivo, muitas rações ricas em cereais contêm, na sua formulação final, a enzima fitase como aditivo. O esquema de ação dessa enzima sobre o fitato está representado na figura.
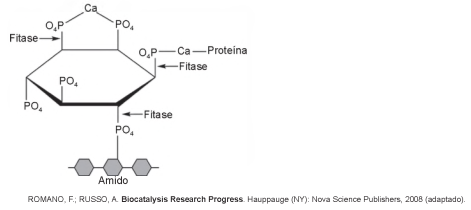
A adição de fitase nessas rações acarretará um aumento da
- a) eliminação de produtos nitrogenados.
- b) disponibilidade de nutrientes.
- c) desnaturação de proteínas.
- d) assimilação de fltato.
- e) absorção de amido.
- #88698
- Banca
- INEP
- Matéria
- Química
- Concurso
- ENEM
- Tipo
- Múltipla escolha
- Comentários
- Seja o primeiro a comentar
(1,0) 5 -
As células e os organismos precisam realizar trabalho para permanecerem vivos e se reproduzirem. A energia metabólica necessária para a realização desse trabalho é oriunda da oxidação de combustíveis, gerados no ciclo do carbono, por meio de processos capazes de interconverter diferentes formas da energia.
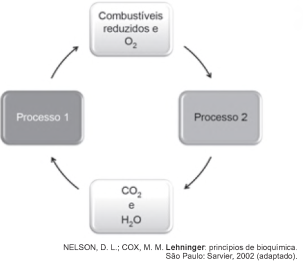
Nesse ciclo, a formação de combustíveis está vinculada à conversão de energia
- a) térmica em cinética.
- b) química em térmica.
- c) eletroquímica em calor.
- d) cinética em eletromagnética.
- e) eletromagnética em química.
- #88701
- Banca
- INEP
- Matéria
- Química
- Concurso
- ENEM
- Tipo
- Múltipla escolha
- Comentários
- Seja o primeiro a comentar
(1,0) 6 -
O sulfeto de mercúrio(ll) foi usado como pigmento vermelho para pinturas de quadros e murais. Esse pigmento, conhecido como vermilion, escurece com o passar dos anos, fenômeno cuja origem é alvo de pesquisas. Aventou-se a hipótese de que o vermilion seja decomposto sob a ação da luz, produzindo uma fina camada de mercúrio metálico na superfície. Essa reação seria catalisada por íon cloreto presente na umidade do ar.
WOGAN, T. Mercury's Dark Influence on Art. Disponível em: www.chemistryworld.com. Acesso em: 26 abr. 2018 (adaptado).
Segundo a hipótese proposta, o íon cloreto atua na decomposição fotoquímica do vermilion
- a) reagindo como agente oxidante.
- b) deslocando o equilíbrio químico.
- c) diminuindo a energia de ativação.
- d) precipitando cloreto de mercúrio.
- e) absorvendo a energia da luz visível.
- #88705
- Banca
- INEP
- Matéria
- Química
- Concurso
- ENEM
- Tipo
- Múltipla escolha
- Comentários
- Seja o primeiro a comentar
(1,0) 7 -
A ozonólise, reação utilizada na indústria madeireira para a produção de papel, é também utilizada em escala de laboratório na síntese de aldeídos e cetonas. As duplas ligações dos alcenos são clivadas pela oxidação com o ozônio (O3), em presença de água e zinco metálico, e a reação produz aldeídos e/ou cetonas, dependendo do grau de substituição da ligação dupla. Ligações duplas dissubstituídas geram cetonas, enquanto as ligações duplas terminais ou monossubstituídas dão origem a aldeídos, como mostra o esquema.
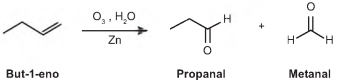
Considere a ozonólise do composto 1-fenil-2-metilprop-1-eno:
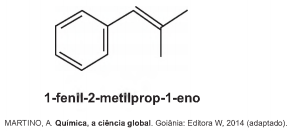
Quais são os produtos formados nessa reação?
- a) Benzaldeído e propanona.
- b) Propanal e benzaldeído.
- c) 2 -fenil-etanal e metanal.
- d) Benzeno e propanona.
- e) Benzaldeído e etanal.
- #88740
- Banca
- INEP
- Matéria
- Química
- Concurso
- ENEM
- Tipo
- Múltipla escolha
- Comentários
- Seja o primeiro a comentar
(1,0) 8 -
O ácido acetilsalicílico, AAS (massa molar igual a 180 g/mol), é sintetizado a partir da reação do ácido salicílico (massa molar igual a 138 g/mol) com anidrido acético, usando-se ácido sulfúrico como catalisador, conforme a equação química:
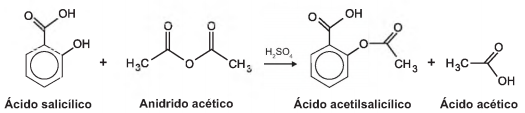
Após a síntese, o AAS é purificado e o rendimento flnal é de aproximadamente 50%. Devido às suas propriedades farmacológicas (antitérmico, analgésico, anti-inflamatório e antitrombótico), o AAS é utilizado como medicamento na forma de comprimidos, nos quais se emprega tipicamente uma massa de 500 mg dessa substância.
Uma indústria farmacêutica pretende fabricar um lote de 900 mil comprimidos, de acordo com as especificações do texto. Qual é a massa de ácido salicílico, em kg, que deve ser empregada para esse fim?
- a) 293
- b) 345
- c) 414
- d) 690
- e) 828
- #88741
- Banca
- INEP
- Matéria
- Química
- Concurso
- ENEM
- Tipo
- Múltipla escolha
- Comentários
- Seja o primeiro a comentar
(1,0) 9 -
Combustíveis automotivos têm sido adulterados pela adição de substâncias ou materiais de baixo valor comercial. Esse tipo de contravenção pode danificar os motores, aumentar o consumo de combustível e prejudicar o meio ambiente. Vários testes laboratoriais podem ser utilizados para identificar se um combustível está ou não adulterado. A legislação brasileira estabelece que o diesel, obtido do petróleo, contenha certa quantidade de biodiesel. O quadro apresenta valores de quatro propriedades do diesel, do biodiesel e do óleo vegetal, um material comumente utilizado como adulterante.
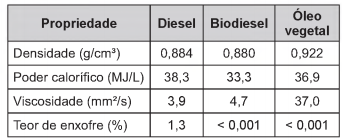
Com base nas informações apresentadas no quadro, quais são as duas propriedades que podem ser empregadas tecnicamente para verificar se uma amostra de diesel comercial está ou não adulterada com óleo vegetal?
- a) Densidade e viscosidade.
- b) Teor de enxofre e densidade.
- c) Viscosidade e teor de enxofre.
- d) Viscosidade e poder calorífico.
- e) Poder calorífico e teor de enxofre.
- #88742
- Banca
- INEP
- Matéria
- Química
- Concurso
- ENEM
- Tipo
- Múltipla escolha
- Comentários
- Seja o primeiro a comentar
(1,0) 10 -
As águas dos oceanos apresentam uma alta concentração de íons e pH entre 8,0 e 8,3. Dentre esses íons estão em equilíbrio as espécies carbonato (CO32-) e bicarbonato (HCO3-), representado pela equação química:
HCO3-(aq) ? CO32-(aq) + H+(aq)
As águas dos rios, ao contrário, apresentam concentrações muito baixas de íons e substâncias básicas, com um pH em torno de 6. A alteração significativa do pH das águas dos rios e oceanos pode mudar suas composições químicas, por precipitação de espécies dissolvidas ou redissolução de espécies presentes nos sólidos suspensos ou nos sedimentos.
A composição dos oceanos é menos afetada pelo lançamento de efluentes ácidos, pois os oceanos
- a) contêm grande quantidade de cloreto de sódio.
- b) contêm um volume de água pura menor que o dos rios.
- c) possuem pH ácido, não sendo afetados pela adição de outros ácidos.
- d) têm a formação dos íons carbonato favorecida pela adição de ácido.
- e) apresentam um equilíbrio entre os íons carbonato e bicarbonato, que atuam como sistema-tampão.
- #88743
- Banca
- INEP
- Matéria
- Química
- Concurso
- ENEM
- Tipo
- Múltipla escolha
- Comentários
- Seja o primeiro a comentar
(1,0) 11 -
Atualmente, soldados em campo, seja em treinamento ou em combate, podem aquecer suas refeições, prontas e embaladas em bolsas plásticas, utilizando aquecedores químicos, sem precisar fazer fogo. Dentro dessas bolsas existe magnésio metálico em pó e, quando o soldado quer aquecer a comida, ele coloca água dentro da bolsa, promovendo a reação descrita pela equação química:
Mg (s) + 2 H2O (I) ? Mg(OH)2 (s) + H2 (g) + 350 kJ
O aquecimento dentro da bolsa ocorre por causa da
- a) redução sofrida pelo oxigênio, que é uma reação exotérmica.
- b) oxidação sofrida pelo magnésio, que é uma reação exotérmica.
- c) redução sofrida pelo magnésio, que é uma reação endotérmica.
- d) oxidação sofrida pelo hidrogênio, que é uma reação exotérmica.
- e) redução sofrida pelo hidrogênio, que é uma reação endotérmica.
- #88744
- Banca
- INEP
- Matéria
- Química
- Concurso
- ENEM
- Tipo
- Múltipla escolha
- Comentários
- Seja o primeiro a comentar
(1,0) 12 -
Adicionar quantidades de álcool à gasolina, diferentes daquelas determinadas pela legislação, é uma das formas de adulterá-la. Um teste simples para aferir a quantidade de álcool presente na mistura consiste em adicionar uma solução salina aquosa à amostra de gasolina sob análise.
Essa metodologia de análise pode ser usada porque o(a)
- a) água da solução salina interage com a gasolina da mistura, formando duas fases, uma delas de álcool puro.
- b) álcool contido na gasolina interage com a solução salina, formando duas fases, uma delas de gasolina pura.
- c) gasolina da mistura sob análise interage com a solução salina, formando duas fases, uma delas de álcool puro.
- d) água da solução salina interage com o álcool da mistura, formando duas fases, uma delas de gasolina com o sal.
- e) álcool contido na gasolina interage com o sal da solução salina, formando duas fases, uma delas de gasolina mais água.
- #88745
- Banca
- INEP
- Matéria
- Química
- Concurso
- ENEM
- Tipo
- Múltipla escolha
- Comentários
- Seja o primeiro a comentar
(1,0) 13 -
A bauxita é o minério utilizado na fabricação do alumínio, a qual apresenta Al2O3 (alumina) em sua composição. Após o trituramento e lavagem para reduzir o teor de impurezas, o minério é misturado a uma solução aquosa de NaOH (etapa A). A parte sólida dessa mistura é rejeitada e a solução resultante recebe pequenos cristais de alumina, de onde sedimenta um sólido (etapa B). Esse sólido é aquecido até a obtenção de um pó branco, isento de água e constituído unicamente por alumina. Finalmente, esse pó é aquecido até sua fusão e submetido a uma eletrólise, cujos produtos são o metal puro fundido (Al) e o gás carbônico (CO2).
SILVA FILHO, E. B.; ALVES, M. C. M.; DA MOTTA, M. Lama vermelha da indústria de beneficiamento de alumina: produção, características, disposição e aplicações alternativas. Revista Matéria, n. 2, 2007.
Nesse processo, as funções das etapas A e B são, respectivamente,
- a) oxidar a alumina e outras substâncias e reduzir seletivamente a alumina.
- b) solubilizar a alumina e outras substâncias e induzir a precipitação da alumina.
- c) solidificar as impurezas alcalinas e deslocar o equilíbrio no sentido da alumina.
- d) neutralizar o solo ácido do minério e catalisar a reação de produção da alumina.
- e) romper as ligações químicas da alumina e diminuir o calor de formação do alumínio.
- #88746
- Banca
- INEP
- Matéria
- Química
- Concurso
- ENEM
- Tipo
- Múltipla escolha
- Comentários
- Seja o primeiro a comentar
(1,0) 14 -
Na preparação da massa do pão, presente na mesa do café da maioria dos brasileiros, utiliza-se o fungo Saccharomyces cerevisiae vivo, contido no fermento. Sua finalidade é fazer com que a massa cresça por meio da produção de gás carbônico.
Esse processo químico de liberação de gás é causado pela
- a) glicogênese lática.
- b) fermentação alcoólica.
- c) produção de ácido lático.
- d) produção de lactobacilos.
- e) formação do ácido pirúvico.
- #88747
- Banca
- INEP
- Matéria
- Química
- Concurso
- ENEM
- Tipo
- Múltipla escolha
- Comentários
- Seja o primeiro a comentar
(1,0) 15 -
O aquecimento de um material por irradiação com micro-ondas ocorre por causa da interação da onda eletromagnética com o dipolo elétrico da molécula. Um importante atributo do aquecimento por micro-ondas é a absorção direta da energia pelo material a ser aquecido. Assim, esse aquecimento é seletivo e dependerá, principalmente, da constante dielétrica e da frequência de relaxação do material. O gráfico mostra a taxa de aquecimento de cinco solventes sob irradiação de micro-ondas.
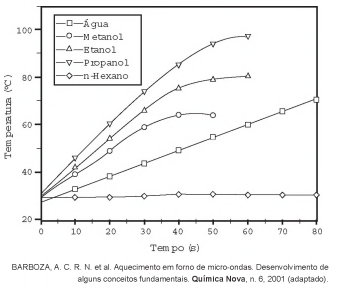
No gráfico, qual solvente apresenta taxa média de aquecimento mais próxima de zero, no intervalo de 0 s a 40 s?
- a) H2O
- b) CH3OH
- c) CH3CH2OH
- d) CH3CH2CH2OH
- e) CH3CH2CH2CH2CH2CH3

